资讯 天津科技大学:ARTP联合高通量筛选技术选育 高产尿苷生产菌
天津科技大学陈宁教授、谢希贤教授团队利用ARTP育种技术结合96孔板高通量筛选技术,获得了良好的尿苷生产和遗传稳定性的突变菌F126。该突变菌在摇瓶培养30 h及在补料分批发酵48 h分别获得尿苷5.7g/L、30.3g/L,分别是原始菌株的4.4倍、8.7倍。将筛选到的尿苷高产突变菌中的嘧啶核苷酸操纵子基因进行序列分析表明,氨甲酰磷酸合成酶大亚基上的两个突变位点:P1016L和E949*,这两个突变位点对于尿苷5'-单磷酸(UMP)转化为尿苷是关键性的位点。本次研究成果于2017年6月成功发表在国际主流期刊《PLOS ONE》上(文章题目:Improvement of uridine production of Bacillus subtilis by atmospheric and room temperature plasma mutagenesis and highthroughput screening)。

尿苷是重要的合成药物的中间体,广泛地用于制药工程中抗病毒和抗肿瘤药物的前体。传统的尿苷生产方法有化学合成法和RNA水解法,两种方法都存在原料成本高的限制,且化学合成法还会对环境造成很大的负担,RNA水解法受到酶生产的限制。采用微生物发酵法可以将廉价的原料直接转化成具有高附加值的产品,具有周期短、易控制、无污染、产率高等优势,是目前尿苷生产研究的重点和热点。
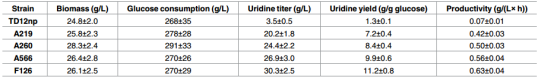
天津科技大学陈宁教授、谢希贤教授团队以本实验室的枯草芽胞杆菌TD12np(trpC2,ΔaraR:: Para-neoR,Δcdd,Δhom,ΔpyrR,ΔnupC-pdp)作为初始菌株,采用进行三轮ARTP诱变,分别经200,300和400mg/L的2-硫尿嘧啶筛选,然后将获得的突变优势菌再次经过三轮的ARTP诱变,并依次采用UMP类似物100mg / L 6-氮尿嘧啶(100mg / L)、6-氮尿嘧啶(3g / L)、5-氟尿嘧啶(200mg/L)耐受性筛选,最终获得4株嘧啶核苷产量较原始菌株有明显提高的突变株,分别是A219、A260、A566、F126。这四株菌在摇瓶发酵下,尿苷的产量分别是3.1,4.7,5.2,5.7g/L(分别是原始菌株2.3,3.6,3.9,4.4倍)。进一步分析这四株突变菌的遗传稳定性,该团队采用摇瓶发酵培养,经过10次传代,结果显示每代菌种尿苷产量波动性不大,其高产性能稳定,产量性状稳定遗传。为了较为准确的评估所筛选菌株的发酵性能,将所筛到的几株突变菌进行5L罐进行补料分批发酵,结果表明5L罐发酵尿苷的产量较摇瓶大幅提升,其中F126在发酵48h后,尿苷产量最*,达到30.3 g/L,是原始菌株的8.7倍。
为了进一步阐明机理,他们将所筛菌株嘧啶核苷(pyr)操纵子序列进行测序发现,突变菌A219中pyrAB基因第3047位碱基发生突变,C变为T,导致氨甲酰磷酸合成酶大亚基1016位的脯氨酸转变为亮氨酸;A260、A566和F126中pyrAB基因第2846、2847 和2848位的AAG 缺失,最终导致氨甲酰磷酸合成酶大亚基的949位的谷氨酸缺失;四株菌嘧啶核苷操纵子的其它基因都未见突变。结合现有报道及他们的研究结果,他们推测,氨甲酰磷酸合成酶上第949个和1016个氨基酸是和尿苷酸结合的两个关键位点,这两个位点的突变能够显著影响尿苷酸和氨甲酰磷酸合成酶的结合,从而导致反馈抑制作用的大幅减弱,这或许是所筛菌株尿苷产量大幅提升的关键所在。
文章精选
ARTP诱变设计与高通量筛选
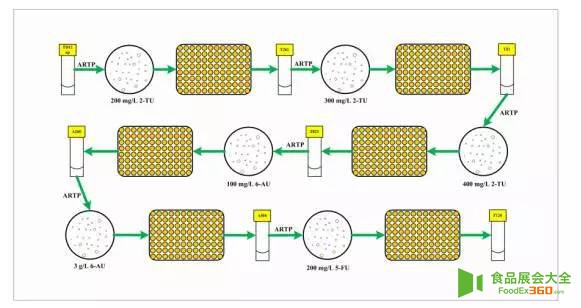
图1 ARTP产生的枯草芽胞杆菌的高通量筛选流程. 2-TU为2-硫尿嘧啶;6-AU为6-氮尿嘧啶、5-FU为5-氟尿嘧啶
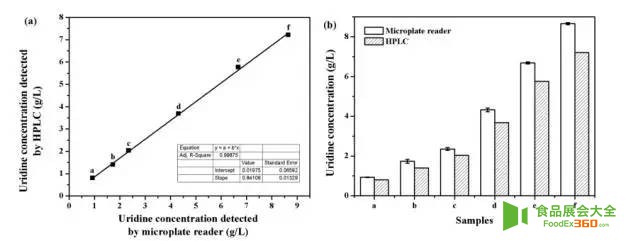
Fig 2. Comparison of uridine concentration detected by microplate reader and HPLC. (a) Correlation coefficient of the two methods; (b)Measured values of uridine concentration in microplate.
图2 酶标仪和HPLC检测的尿苷浓度比较. (a)两种方法的相关系数; (b)微孔板中尿苷浓度的测定值.
2、高产尿苷突变菌的选择
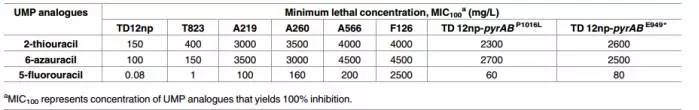
Table 1. Effect of UMP analogues on the growth of parent and mutant strains.表1 UMP类似物对原始菌株及突变株生长的影响
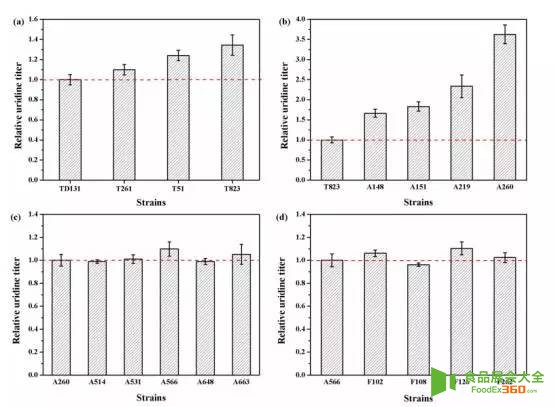
3、代表性突变菌的表征
Table 2. Pyrimidine nucleoside produced by parent and mutant strains in 30 h shake-flask fermentation.
表2 在30小时摇瓶发酵中原始菌和突变菌产生的嘧啶核苷

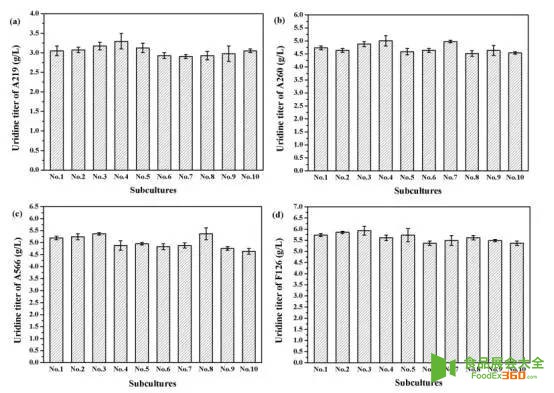
Fig 4. Stability test of mutant strains in ten batches sub-cultures. (a) Mutant A219; (b) Mutant A260; (c) Mutant A566; (d) Mutant F126.
图4.突变菌株10次传代的稳定性试验. (a)突变株A219;(b)突变体A260;(c)突变体A566;(d)突变体F126.
4、5L罐上的发酵性能检测
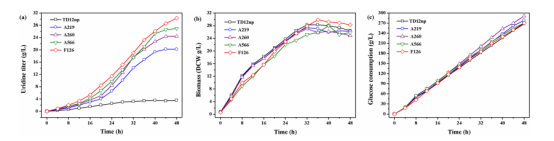
Fig 5. Time course of uridine production by mutant A219, A260, A566, F126 and parent strain TD12np in 48 h fed-batch fermentation. (a) Uridine titer; (b) Biomass; (c) Glucose consumption.
图5 突变体A219,A260,A566,F126和原始菌TD12np在48小时分批补料发酵过程. (a)尿苷产量; (b)生物情况;(c)耗糖情况.
Table 3. Fermentation parameters of parent and mutant strains in 48 h fed-batch fermentation.
表3 48h补料发酵的参数
5、所筛菌株嘧啶核苷操纵子的基因序列比对
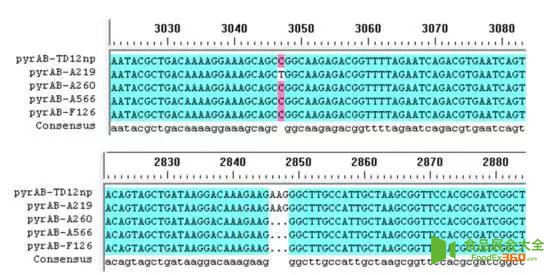
Fig 6. Multiple-sequence alignment of pyrAB gene in mutant A219, A260, A566, F126 and parent strain TD12np.
图6 突变菌A219,A260,A566,F126和原始菌株TD12np中pyrAB基因的多序列比对


